국내 코로나19 치료제 개발 현황
한국에서는 셀트리온 '렉키로나주'를 비롯해 코로나19 치료제로 개발 중인 항체치료제 등 총 15개 제품(13개 성분)에 대한 임상시험이 진행 중입니다.
식약처는 앞으로도 개발되는 코로나19 치료제 및 백신의 허가신청이 있을 경우 안전성과 효과성을 철저히 검증하는 한편 최대한 신속히 허가할 계획입니다.

▶ 코로나19 백신 치료제 허가 및 심사 절차
접수 → 예비심사 → 심사 → 자문 → 최종 허가 → 국가출하승인 단계를 거칩니다.
➊ 접수 : 업체가 허가신청서 및 비임상시험, 임상시험, 품질, 위해성관리계획 등의 관련자료를 식약처에 제출한다.
➋ 예비심사 : 허가에 필요한 요건 충족 여부 등 심사 타당성을 검토한다.
➌ 심사 : 코로나19 백신·치료제 허가전담심사팀이 8개 분야별 전문가 심사 후 허가 타당성을 판단한다
➍ 외부전문가 자문 : 종합 심사 의견을 토대로 안전성, 효과성 검증자문단과 중앙약사심의위원회 자문을 진행한다.
1. 검증 자문단
2. 중앙약사심의위원회
3. 최종점검위원회
➎ 최종 허가 : 신청 제품에 대한 허가 심사 및 전문가 자문 결과 안전성, 효과성이 충분히 확인되는 경우 허가를 진행한다.
➏ 국가출하 승인 : 생물학적 제제인 백신은 국가가 한번 더 품질 확인 후 유통, 판매한다.
▶ 코로나19 백신 치료제 허가 승인 상황
- 임상 1상 : 최초로 사람에게 투여하여 안전성, 약동학 등을 평가한다.
- 임상 2상 : 1상 종료 후, 대상 환자들에게 투여하여 치료효과를 탐색한다.
- 임상 3상 : 2상 종료 후, 많은 환자들에게 투여하여 안전성 및 치료효과를 확증한다.
- 1상과 2상(1/2상) 또는 2상과 3상(2/3상)을 동시 진행하거나 각 임상의 진행에 따라 a, b (전기, 후기)로 구분하기도 합니다.
< 임상승인 → 사전검토 → 허가심사 → 허가완료 → 국가출하승인 >
- 허가심사 기간 단축 : 현행 180일 이상 → 40일 이내
- 국가출하승인 기간 단축 : 현행 연 2~3개월 → 20일 이내

- 2021년 1월 17일 기준
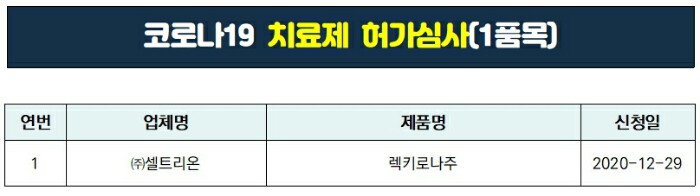
▶ 코로나19 치료제 허가심사 단계 (1품목)
1. 셀트리온
- 제품명 : 렉키로나주
- 신청일 : 2020.12.29
식약처는 2021년 1월 17일(일) 코로나19 치료제 셀트리온 '렉키로나주'에 대한 검증 자문단 회의를 실시하고 1월 18일(월) 결과를 공개합니다.

▶ 코로나19 치료제 임상승인 단계 (15품목)
1. 부광약품
- 제품명 (성분명) : 레보비르 캡슐30mg (클레부딘)
- 임상 단계 : 2상
- 임상 승인일 : 2020.4.14, 2021.1.7
- 임상시험 내용 : 중등증 코로나19 환자 대상 시판 의약품(B형간염약)의 안전성, 유효성 평가
2. 엔지켐 생명과학
- 제품명 (성분명) : EC-18
- 임상 단계 : 2상
- 승인일 : 2020.5.12
- 임상시험 내용 : 코로나19 폐렴환자 대상 임상시험, 의약품(호중구감소증약)의 안전성, 유효성 평가
3. 신풍제약
- 제품명 (성분명) : 피라맥스정 (피로라리딘, 알테수네이트)
- 단계 : 2상
- 승인일 : 2020.5.13
- 임상시험 내용 : 경증 또는 중등증 코로나19 환자 대상 시판, 의약품의 안전성 유효성 및 안전성 비교 평가
4. 종근당
- 제품명 (성분명) : CKD-314 (나파모스타트)
- 단계 : 2상
- 승인일 : 2020.6.17
- 임상시험 내용 : 코로나19 폐렴 입원환자 대상 시판 의약품(항응고제)의 안전성, 유효성 평가
5. 크리스탈 지노믹스
- 제품명 (성분명) : CG-CAM20 (카모스타트)
- 단계 : 2상
- 승인일 : 2020.7.1
- 임상시험 내용 : 코로나19 환자 대상 시판 의약품(췌장염약)의 안전성, 유효성 평가
6. 대웅제약
- 제품명 (성분명) : DW1248정 (카모스타트)
- 임상 단계 : 2·3상
- 임상 승인일 : 2020.7.6
- 임상시험 내용 : 경증 및 중등증 코로나19 환자 대상 시판 의약품(췌장염약) 안전성, 유효성 평가
- 단계 : 3상
- 승인일 2020.12.31
- 임상시험 내용 : 중증 코로나19 환자 대상 DWJ1248과 Remdesivir 병용요법 안전성·유효성 평가
7. 제넥신
- 제품명 (성분명) : GX-I7
- 단계 : 1b상
- 승인일 2020.8.7
- 임상시험 내용 코로나19 환자 대상 임상시험 의약품(항암제)의 안전성, 예비 효과 탐색
8. 녹십자
- 제품명 (성분명) : GC5131
- 단계 : 2a상
- 승인일 : 2020.8.20
- 임상시험 내용 : 코로나19 환자 대상 H-Ig(고면역글로불린)의 용량 설정 및 유효성, 안전성 평가
9. 셀트리온
- 제품명 (성분명) : CT-P59
- 단계 : 1상
- 승인일 : 2020.8.25
- 임상시험 내용 : 코로나19 경증 환자 대상 안전성, 내약성 및 바이러스학 평가
- 단계 2·3상
- 승인일 : 2020.9.17
- 임상시험 내용 : 경증, 중등증 코로나19 환자 대상 표준 치료와 병행하여 안전성, 유효성 평가
- 임상 단계 : 3상
- 승인일 2020.10.8
- 임상시험 내용 : 코로나19 환자 접촉자 대상 예방적 유효성, 바이러스학 및 안전성 평가
10. 한국릴리
- 제품명 (성분명) : LY 3009104 (바리시티닙)
- 단계 : 3상
- 승인일 2020.9.7
- 임상시험 내용 : 코로나19 환자에 대한 시판 의약품(관절염약)의 치료적 확증 시험
11. 대웅제약
- 제품명 (성분명) : DWRX2003 (니클로사미드)
- 단계 : 1상
- 승인일 : 2020.10.8
- 임상시험 내용 : 건강한 성인 대상 시판 의약품(구충제)의 안전성, 내약성 및 약동학적 특성 평가
12. 한국엠에스디
- 제품명 (성분명) : MK-4482
- 단계 : 2·3상
- 승인일 2020.10.29
- 임상시험 내용 : 코로나19 성인 입원 환자 대상 임상시험 의약품(인플루엔자약)의 안전성, 유효성, 약동학 평가
13. 뉴젠 테라퓨틱스
- 제품명 (성분명) : 뉴젠나파모스타트정 (나파모스타트)
- 단계 : 1상
- 승인일 : 2020.11.3
- 임상시험 내용 : 건강한 성인 남성 대상 시판 의약품(항응고제)의 안전성, 내약성 및 약동학적 특성 평가
14. 동화약품
- 제품명 (성분명) : DW2008S
- 단계 : 2상
- 승인일 : 2020.11.23
- 임상시험 내용: 중등증 코로나19 환자 대상 임상시험 의약품(천식약)의 안전성, 유효성 비교 평가
15. 이뮨메드
- 제품명 (성분명) : hzVSF-v13
- 단계 : 2상
- 승인일 : 2020.12.7
- 임상시험 내용 : 코로나19 중등증 및 중증 환자 대상 임상시험 의약품(인플루엔자약)의 표준 요법과 각 용량 별 hzVSF-v13 병용투여 시 안전성, 유효성 및 안전성을 단독 표준 요법군과 비교 평가



'뉴스' 카테고리의 다른 글
| 2021년 문화누리카드 자동 재충전 및 신규발급 신청 안내 (0) | 2021.01.20 |
|---|---|
| 방문돌봄종사자와 방과후교사 한시지원금 신청 및 방법 (0) | 2021.01.18 |
| 코로나 백신 구매 계약 및 허가 심사 승인 상황 (0) | 2021.01.17 |
| 특수형태근로종사자 및 프리랜서 3차 긴급 고용안정지원금 신규 신청 및 방법 (0) | 2021.01.15 |
| 카드포인트 통합조회 및 계좌이체 신청 이용 방법 (0) | 2021.01.14 |


최근댓글